产品仅供教研使用,用于定量检测细胞培养上清、血清、血浆中 大鼠αCTx。
简介
α-骨胶原交联(αCTx)是一种用于检测骨吸收的生物标志物,主要通过酶联免疫吸附试验(ELISA)方法进行检测。其检测原理是利用双抗体夹心法,通过抗aCTx单克隆抗体与样本中的aCTx结合,形成复合物,再通过酶标抗体检测其浓度,aCTx是Ⅰ型胶原降解产物的一部分,具有较高的特异性和稳定性,常用于骨质疏松症及其他骨病的诊断和治疗效果监测。
本试剂盒采用双抗体夹心法ELISA技术:将捕获抗体包被于酶标板上,捕获样品及标准品中的待测物αCTx,清洗后,再加入生物素标记的检测抗体进行孵育后清洗,形成“捕获抗体-抗原-检测抗体”免疫复合物,随后加入链霉亲和素偶联的辣根过氧化物酶进行孵育,待孵育结束后清洗,接着加入TMB显色后,若样本中有待测物则显蓝色,加入终止液停止反应。检测过程中游离的成分均被洗去,用酶标仪在450 nm处测OD值,颜色的深浅和样品中的待测物的含量呈正比,通过绘制标准曲线计算出样本中αCTx的浓度。
8. 佩戴防护手套、防护服、眼睛和面部防护用品。处理后彻底洗手。
抗体工作液配置 : 使用前10分钟,将100×生物素化抗体于1000×g离心1分钟,随后用1×稀释液将100×生物素化抗体稀释成1×生物素化抗体工作液,根据所需用量当日配置当日使用。
酶结合物工作液配置 : 使用前10分钟,将100×SA-HRP溶液于1000×g离心1分钟,随后用1×稀释液将100×SA-HRP稀释成1×SA-HRP工作液,根据所需用量配置。
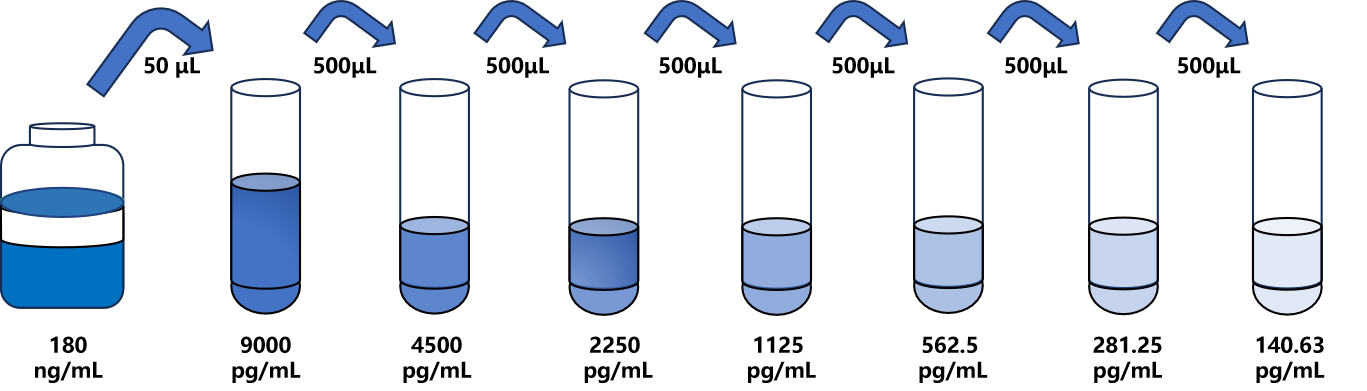
备 注:如待测样本中αCTx浓度高于标准品最高值,请根据实际情况选择适当的稀释倍数。
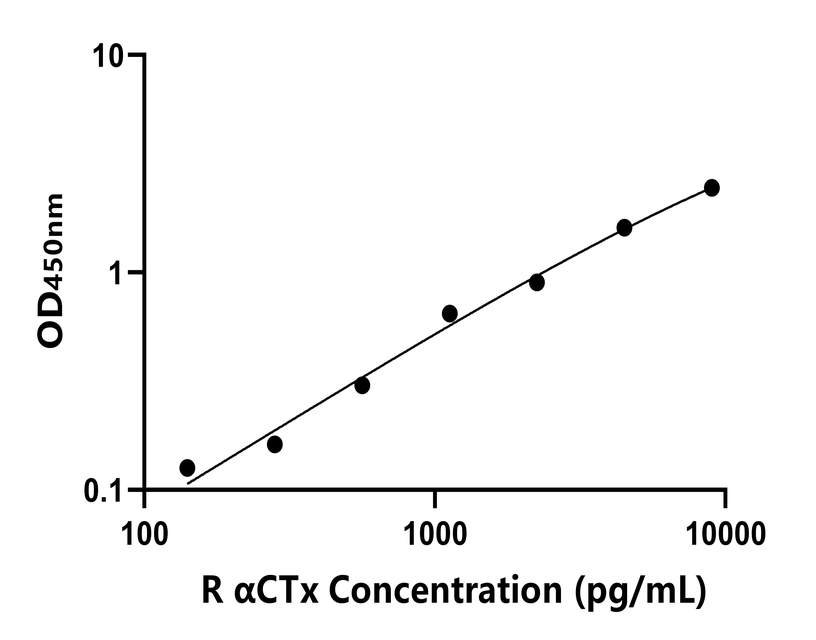
以下数据和曲线仅供参考,实验者需根据自己的实验数据建立标准曲线。
|
标准品浓度(pg/mL) |
9000 |
4500 |
2250 |
1125 |
562.5 |
281.25 |
140.63 |
0 |
|
OD值 |
2.518 |
1.673 |
0.966 |
0.713 |
0.37 |
0.229 |
0.193 |
0.067 |
|
校正OD值 |
2.451 |
1.606 |
0.899 |
0.646 |
0.303 |
0.162 |
0.126 |
0 |

本图所示标准曲线仅供示例,结果计算应以同次试验标准品所绘标准曲线为准计算样本结果。
实验步骤
6. 终止反应:待显色反应结束后,每孔加入50μL终止液,轻轻混匀,5分钟内用预热完成的酶标仪在450nm处测吸光值。
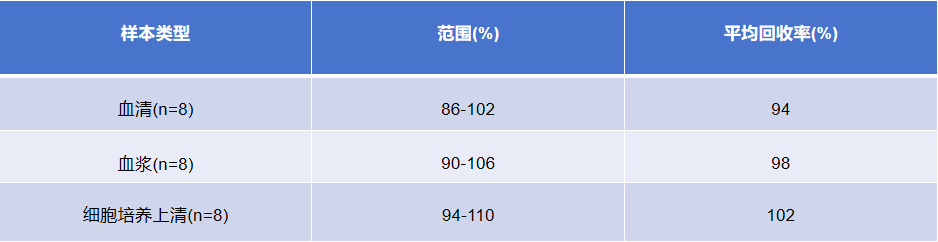
回收率
回收率在不同基质的整个测定范围内选取在健康 大鼠血清、血浆和细胞培养上清中加入3个不同浓度水平计算回收率。
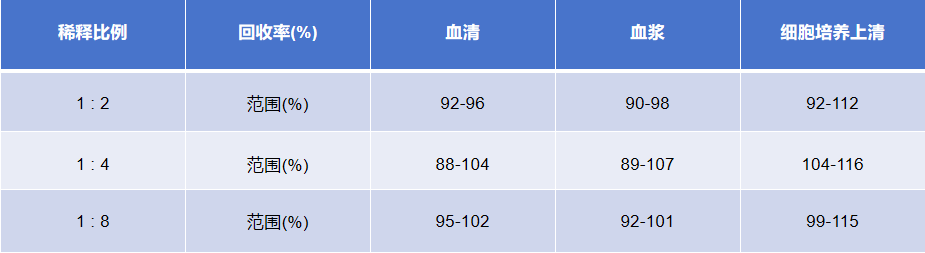
线性关系
分别在选取的4份健康 大鼠血清、血浆和细胞培养上清中加入高浓度αCTx,在标准曲线动力学范围内进行稀释,评估线性。
注意事项
本公司 大鼠ELISA试剂盒检测范围、灵敏度等实验数据,因检测样本的不同会有所调整,实际数据以随货说明书为准。
 021-54720761
点我QQ咨询
点我QQ咨询
021-54720761
点我QQ咨询
点我QQ咨询